Óxido, pátina, fuego, comida rancia: todos tienen en común la oxidación. Así que echemos un vistazo a lo que es exactamente.
La vida tal como la conocemos hoy no podría existir sin oxígeno. Entonces, tenemos suerte de que haya tanto alrededor. Pero esta dependencia del oxígeno ha sido, a veces, llamada un “pacto con el diablo”. La misma propiedad que hace que el gas sea vital para la mayoría de la vida en la Tierra, su insaciable sed de electrones, mata lentamente la vida que sustenta.
Hoy, pensé que echaríamos un vistazo más profundo a esta dinámica de dar y quitar vidas preguntando:
¿Qué es la oxidación?
La oxidación es el proceso en el que un átomo arranca electrones de otro, reclamándolos como propios. Es un lado de las reacciones de tipo redox. Estas reacciones de oxidación- reducción se distinguen de otros tipos de interacciones químicas porque involucran cambios en las envolturas de electrones de múltiples átomos. La reducción es el proceso mediante el cual un átomo cede electrones a otro.
El término toma su nombre del oxígeno porque fue el primer elemento oxidativo conocido. De hecho, durante bastante tiempo en el siglo XVIII, la “oxidación” se refería únicamente a la adición de oxígeno a un compuesto. Un buen ejemplo de esta definición tradicional de oxidación puede mostrarse (de manera molesta) en la carrocería de nuestros automóviles: óxido (óxido de hierro).
Desde entonces, hemos aprendido que la oxidación no se limita ni al hierro ni al oxígeno. La mayoría de los elementos se pueden oxidar, con la persuasión adecuada, en una variedad de entornos. Muchos se pueden hacer para oxidar a sus compañeros. Algunos se descascaran y se rompen cuando se oxidan, otros tienden a volverse más resistentes a una mayor oxidación. El proceso se presenta de muchas formas e involucra a muchos actores. Como tal, hemos ampliado la definición de oxidación para incluir todas y cada una de las reacciones en las que un elemento arroja electrones y aumenta su estado de oxidación .
¿Qué es una reacción redox?
Una reacción redox, o reacción de oxidación-reducción, es un tipo de reacción química que implica la transferencia de electrones entre dos sustancias. En una reacción redox, una sustancia se oxida (pierde electrones) mientras que otra se reduce (gana electrones).
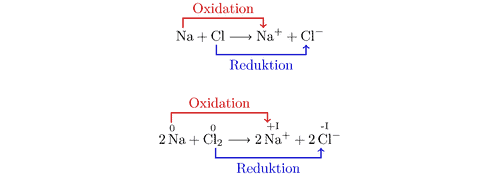
La oxidación y la reducción siempre, siempre , ocurren juntas.
Para enfoques puramente teóricos, las semirreacciones se pueden usar para explicar la mitad de una reacción redox, ya sea el componente de oxidación o el de reducción. Estos son bastante útiles para simplificar todo el proceso, para que sea más fácil de enseñar o comprender. Pero tenga en cuenta la primera línea: en la vida real, la oxidación y la reducción siempre van juntas.
Sencillamente, un electrón no querrá dejar su átomo anfitrión. No entrará en la naturaleza de cualquier manera. No hay nada para satisfacer su desequilibrio eléctrico allí. Pero tener un anfitrión más acogedor cerca para pasar puede sacarlo . La oxidación, entonces, no puede ocurrir a menos que haya un átomo sediento de electrones alrededor. Por otro lado, sin un donante de electrones, no hay transferencia. La reducción, entonces, no puede ocurrir si no hay nadie a quien quitarle los electrones.
Piense en ello como un mercado. Necesitas compradores para tener vendedores y viceversa; uno simplemente no puede suceder sin el otro.
Echemos un vistazo más de cerca a este proceso. Imagina que tenemos una reacción entre el hierro y el cobre. El hierro es más reactivo que el cobre, lo que significa que tiene una mayor tendencia a perder electrones. Cuando las dos sustancias se combinan, los átomos de hierro cederán electrones a los átomos de cobre, que los aceptarán.
Esto significa que los átomos de hierro se oxidan, mientras que los átomos de cobre se reducen. El hierro actúa como agente reductor, mientras que el cobre actúa como agente oxidante. Esta transferencia de electrones entre las dos sustancias es lo que impulsa la reacción.
Ok, entonces, ¿por qué lo llamamos ‘reducción’? Una vez más, es la historia en el trabajo. No pudimos comprender correctamente la química durante mucho tiempo, pero pudimos observar y medir algunos de sus efectos. ‘Reducción’ es en realidad un término metalúrgico. Los fundidores (¿o los herreros, supongo?) podrían ver que refinar una pieza de mineral de una libra generaría menos de una libra de metal. No sabían por qué, pero podían ver la caída en la cantidad, por lo que se refirieron a ella como ‘reducir el mineral a su metal base’.
Alerta de spoiler: esa masa perdida es oxígeno (o hidrógeno y oxígeno) que se separa químicamente de los óxidos/hidróxidos metálicos en los hornos. Pero el nombre se quedó. De manera algo confusa, en mi opinión, los químicos dicen que un átomo gana electrones cuando se reduce. Pierde electrones durante la oxidación.
Un truco útil para ayudarte a recordar esto es la PLATAFORMA PETROLERA: la oxidación es pérdida, la reducción es ganancia.
Las reacciones redox son increíblemente importantes en muchas áreas de la ciencia, incluidas la biología, la química y las ciencias ambientales. Desempeñan un papel crucial en la descomposición de los alimentos en nuestro cuerpo, la producción de energía en nuestras células y la degradación de los contaminantes en el medio ambiente.
Veámoslo en acción

Imagine que estamos trabajando en una acería y recibimos un envío de mineral de hierro (Fe) y carbón (C). Cuando los echamos al horno, sucede esto:
2Fe2O3+3C→4Fe+3CO2
Este hierro comienza con un estado de oxidación de +3 (cada átomo dona 3 electrones) y su oxígeno comienza con un estado de oxidación de -2 (cada átomo acepta 2 electrones). El carbono del carbón tiene una carga eléctrica neutra (el estado de oxidación es 0 para todos los elementos puros). Al oxígeno, sin embargo, le gusta unirse al carbono mucho más de lo que le gusta unirse al hierro. Le devolverá al hierro sus electrones y se unirá al carbono, tomando sus electrones en su lugar. Esto cambia el estado de oxidación del hierro de +3 a 0, ya que ahora es un elemento puro, por lo que no hay nadie a quien donarlo, y el del carbono de 0 a -4 (ya que se une a dos átomos de oxígeno, cada uno de los cuales ocupa 2 electrones).
Al oxígeno le gusta unirse al carbono más que al hierro porque el primero tiene más electrones para dar. Por lo tanto, tiene una carga electronegativa más poderosa, lo que significa que atrae el oxígeno con más fuerza que el hierro. El carbono es el agente reductor aquí, mientras que el oxígeno es el agente oxidante.
Precaución a los sabios
Otra definición de oxidación, que puede encontrar especialmente en química orgánica, es la pérdida de hidrógeno. Nuevamente, algo confuso, pero tiene sentido. Veamos la oxidación del etanol (lo que usamos para emborracharnos) en etanal (acetaldehído) para hacerlo más simple.
CH3CH2OH + [O] → CH3CHO + H2O
El hidrógeno es el átomo más simple: es un protón orbitado por un electrón. Suele ceder dicho electrón al unirse a otras especies químicas a través de enlaces covalentes . Para simplificar demasiado las cosas, el hidrógeno generalmente ayuda a reducir la necesidad de electrones de un elemento cuando se une químicamente a él.
En el ejemplo anterior, la adición de oxígeno al etanol elimina dos átomos de hidrógeno para formar agua; Entonces, en general, el etanol gana oxígeno (que es oxidación) a medida que se transforma en etanal. Alternativamente, puede ver la pérdida de hidrógeno como una pérdida de los electrones que compartió con el resto de la molécula (que, nuevamente, es oxidación).
La importancia de las reacciones redox en biología.
Abundan los ejemplos de oxidación. El hierro se oxida, el alcohol se convierte en vinagre y el carbón de la leña se reduce con el oxígeno a medida que se quema. Mantiene su auto funcionando al permitir la combustión. Hace estatuas de bronce con ese tono majestuoso de verde.
Las células usan un proceso llamado respiración celular para convertir la glucosa en ATP, que es la principal fuente de energía para el cuerpo. Este proceso implica una serie de reacciones redox en las que los electrones se transfieren de la glucosa al oxígeno. E incluso un paso antes de esto, las reacciones redox juegan un papel crucial en la descomposición de los alimentos en nuestros cuerpos en sus moléculas constituyentes, incluida la glucosa. Este proceso implica una serie de reacciones redox en las que se transfieren electrones entre moléculas.
Pero a veces la oxidación es problemática. Puede causar daños extensos y costosos a nuestra infraestructura, nuestra propiedad y nuestros cuerpos. Los radicales libres en su cuerpo dañan las células al oxidar átomos en sus moléculas (los antioxidantes ayudan a prevenir este tipo de daño químico). La oxidación es probablemente uno de los principales impulsores del envejecimiento, ya que el mismo gas que nos mantiene activos oxida lentamente nuestros cuerpos de adentro hacia afuera.
La oxidación es un proceso simple, pero toma muchas formas en varios escenarios, demasiado variados para tratarlos en un solo artículo, y mucho menos en uno en el que se quedaría despierto. Pero sustenta directamente la vida tal como la conocemos, y probablemente también la muerte tal como la conocemos. Así que no debemos tomarlo a la ligera.
Fuente: What is oxidation? A journey through the world of redox reactions



